La Banque de données des mutations du gène DMD
UMD-DMD France
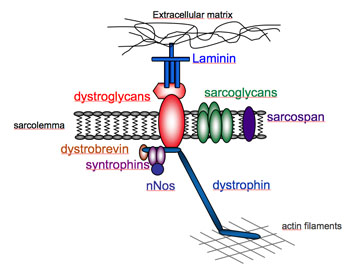
Le complexe associé à la dystrophine
La dystrophine (dans sa forme la plus longue) est une protéine de 427kDa composée de 3685 acides aminés. Dans les fibres musculaires squelettiques elle est localisée au niveau de la face cytoplasmique du sarcolemme (Watkins et al.) où elle représente 5% des protéines du sarcolemme et 0,002% des protéines des muscles striés (Hoffman et al.). La dystrophine est normalement présente depuis le stade fœtale dans tous les muscles squelettiques, le cœur, les muscles lisses et dans certains types de cellules nerveuses.
Au niveau du sarcolemme, la dystrophine fait partie d'une structure macromoléculaire de protéines appelée "complexe associé à la dystrophine" ou "Dystrophin-Associated Protein" (DAP). Ce complexe comprend les sarcoglycanes (α, β, δ, γ, ε), les dystroglycanes (α, β), la dystrobrévine, les syntrophines (α, β), le sarcospan, la cavéoline-3... (Lapidos, K.A. et al.). La dystrophine est liée au cytosquelette intracellulaire via son extrémité N-terminale qui est associée aux filaments d'actine tandis que son extrémité C-terminale interagit avec les membres du DAP notamment le β-dystroglycane. Du côté extracellulaire de la membrane, l'α-dystroglycane lié au β-dystroglycane sert de récepteur pour la matrice extracellulaire.
Structure de la dystrophine
L'analyse de la structure primaire de la dystrophine permet de distinguer quatre domaines structuraux distincts : (1) le domaine N-terminal de liaison à l'actine (aa 14-240), (2) le grand "rod" domaine central de type triple hélice "spectrin-like" (aa 253-3040) qui est composé de 24 unités répétées semblables à celles retrouvées dans la β-spectrine, (3) le domaine riche en cystéines (aa 3080- 3360) et le domaine C-terminal (aa 3361- 3685) (Koenig, M., Monaco, A. P., and Kunkel, L. M.). Un second domaine de liaison à l'actine a été identifié dans la région centrale entre les répétitons de type spectrine 11 à 17. Les régions charnières flexibles (H1-H4) sont des séquences riches en Prolines qui interrompent le "rod" domaine. La région C-terminale contient des domaines de liaison pour certains membres du DAP. Ces sites de liaison comprennent le domaine WW (WW), le domaine ZZ (ZZ) qui est localisé dans la région riche en Cystéines (CYS), le domaine "coiled-coil" (CC) et le domaine C-terminal (CT). Les 15 derniers acides aminés C-terminaux du dystroglycane constituent un site de liaison unique pour la seconde moitié de la charnière 4 et le domaine riche en Cystéines de la dystrophine (amino acids 3054-3271) (Jung et al.). L'extrémité carboxyl-terminale est une hélice α qui interagit avec les syntrophines (Suzuki et al.)
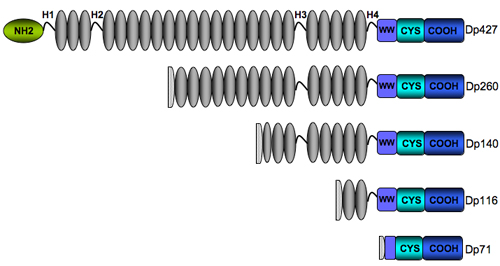
Les quatre isoformes plus courtes de la dystrophine incluent le domaine riche en Cystéines et le domaine C-terminal, conservant ainsi les sites de liaison pour le dystroglycane, la dystrobrévine et la syntrophine, avec des longueurs variables du domain central. Elles ont toutes perdu le domaine de liaison à l'actine ce qui suggére qu'elles pourraient avoir des fonctions différentes de celles décrites pour l'isoforme Dp427. Les mutations touchant les isoformes Dp140 et Dp71 seraient plus fréquemment associées avec un risque d'altération des fonctions cognitives (Bardoni et al., Moizard et al., Mehler).
Rôles de la dystrophine
Les fonctions exactes de la dystrophine ne sont toujours pas élucidées. Elle pourrait stabiliser le sarcolemme et ainsi protéger les fibres musculaires des dommages induits par l'activité de contraction et la nécrose (Davies KE, Nowak KJ). La dystrophine permet de lier le réseau des microfilaments intracellulaires associés à l'actine à un ensemble complexe de protéines de la membrane et indirectement à la matrice extracellulaire (Ervasti and Campbell). Il a été rapporté que l'extrémité C-terminale de la dystrophine, qui est liée au sarcolemme, joue un rôle critique, comme la région de liaison à l'actine, tandis que la région centrale peut être partiellement délétée sans altérer complètement la fonction de la protéine. Des rôles non-structuraux ont également été décrits pour la dystrophine en faisant ainsi une protéine multifonctionnelle. Par exemple, elle interagirait avec plusieurs molécules de signalisation (Rando), interviendrait dans la médiation de différents signaux ou dans l'homéostasie calcique (Chakkalakal et al.).
Dernière mise à jour : 12/10/2009